AG Lorenz
Molekulare Grundlagen von Geschlechtsunterschieden
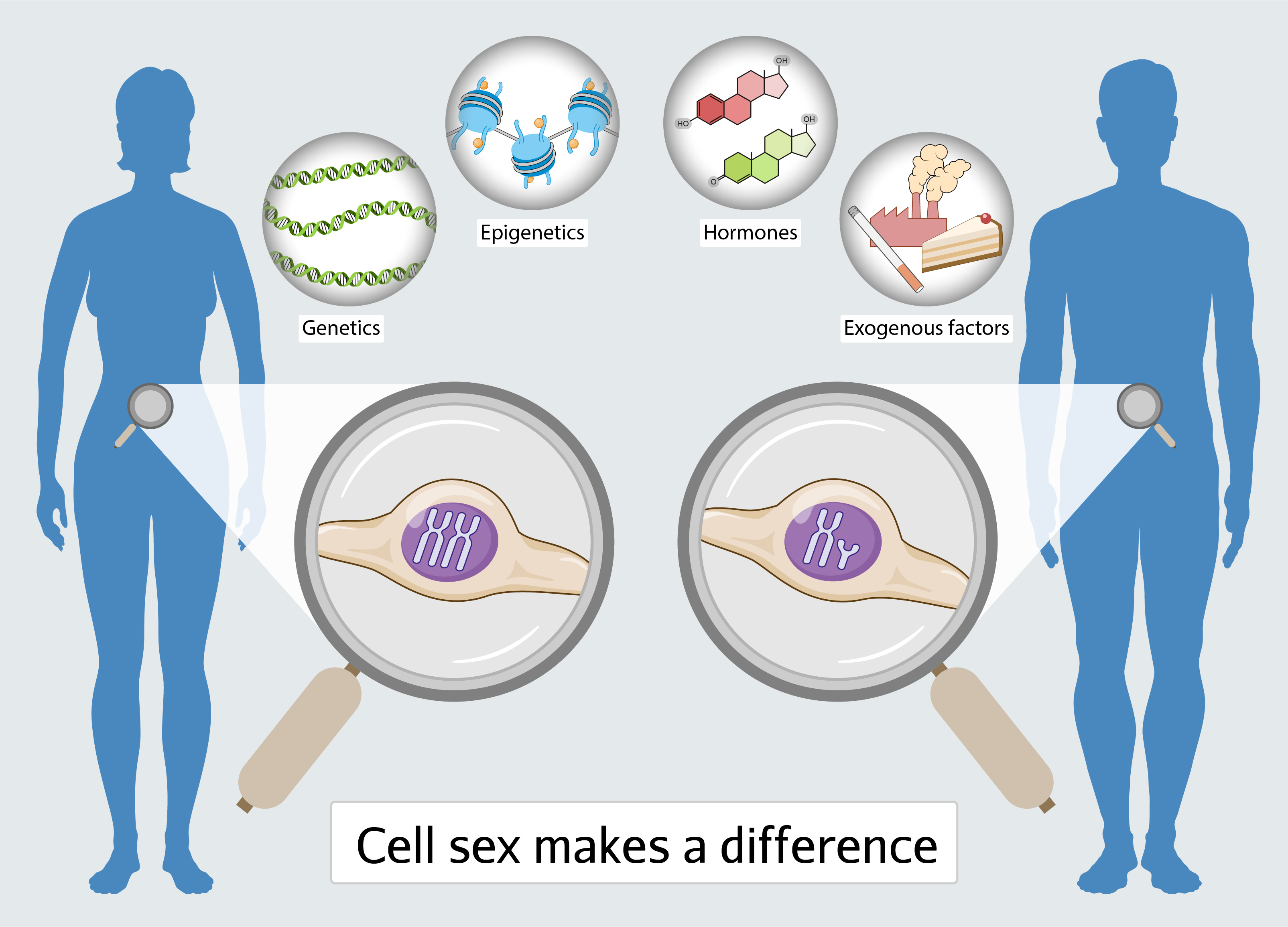
Im klinischen Alltag werden in zunehmendem Maß Geschlechtsunterschiede für nahezu alle Erkrankungen detektiert. Besonders bei Herz-Kreislauf-Erkrankungen sind eine Vielzahl von geschlechtsspezifischen Unterschieden in der Prävalenz, Symptomatik, Behandlung und Mortalität bekannt. Im Rahmen der personalisierten Medizin und des wachsenden Einsatzes von KI werden sie in Zukunft eine immer wichtigere Rolle in der Prävention und bei der Behandlung einnehmen.
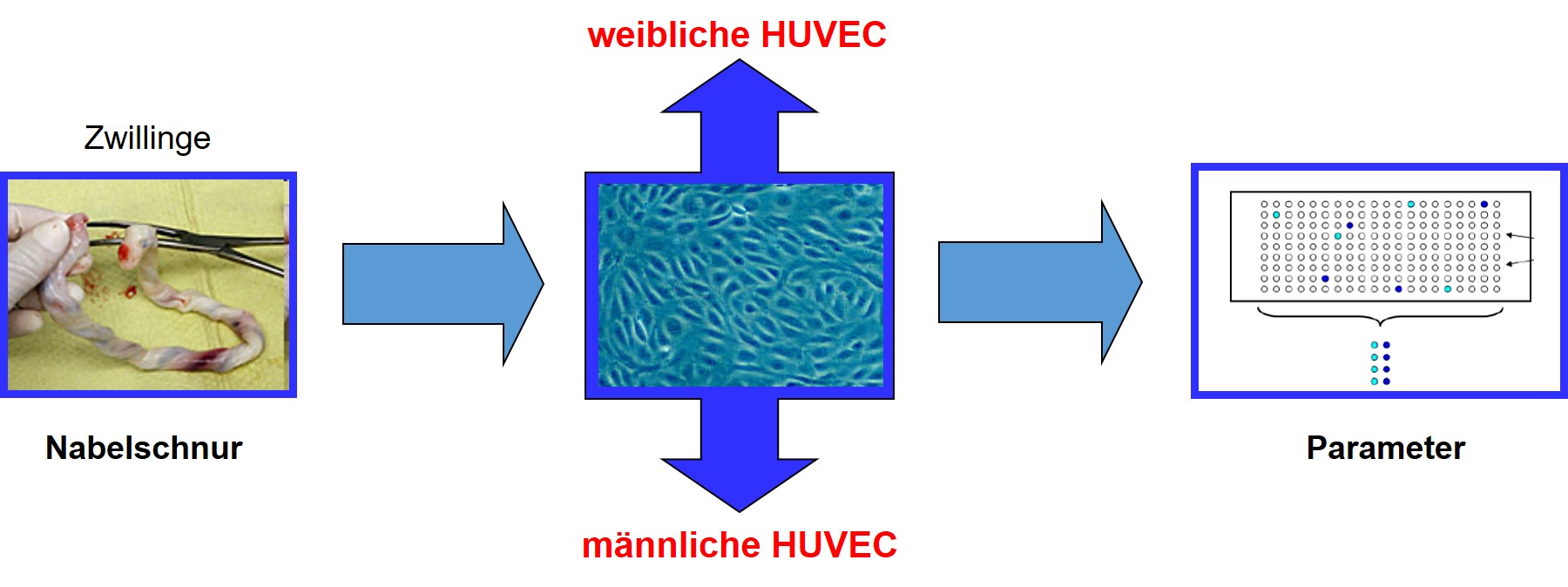
Damit einhergehend kommt der Aufklärung von molekularen Grundlagen für Geschlechterunterschiede eine große Bedeutung zu. In unserer Arbeitsgruppe untersuchen wir Mechanismen geschlechtsspezifischer Unterschiede auf zellulärer Ebene. Dabei arbeiten wir mit weiblichen und männlichen humanen Endothelzellen aus Nabelschnüren getrenntgeschlechtlicher Zwillinge. Diese haben den großen Vorteil, dass sie während der Schwangerschaft den gleichen Bedingungen im Mutterleib ausgesetzt sind (Lebensstil, Ernährung, Medikation, Risikofaktoren und Vorerkrankungen der Mutter). Sie stellen somit ein ausgezeichnetes Modell zur Untersuchung zellulärer Geschlechtsunterschiede dar.
Trennung von weiblichen und männlichen humanen Endothelzellen aus Nabelschnüren getrenntgeschlechtlicher Zwillinge.
Unter verschiedenen physiologischen und kardiovaskulär relevanten pathophysiologischen Bedingungen analysieren wir geschlechtsrelevante Unterschiede auf molekularer, metabolischer und funktioneller Ebene. Dabei konnten wir bereits eine Reihe von molekularen Unterschieden zwischen weiblichen und männlichen Zellen nachweisen (siehe Veröffentlichungen). Diese Untersuchungen schließen eine Vielzahl zellulärer Prozesse ein. Die gewonnenen Erkenntnisse tragen dazu bei, zelluläre geschlechtsspezifische Unterschiede aufzuklären und beteiligte Mechanismen für Geschlechterunterschiede des vaskulären Systems besser zu verstehen. Kooperationen mit Interesse für geschlechtsspezifische Fragestellungen sind jederzeit willkommen.
Leitung:Dr. rer. nat. Mario Lorenz
Team: Angelika Vietzke, Riwka Palant, Haiyan Wu
Förderungen:
- DZHK (Deutsches Zentrum für Herz-Kreislaufforschung)
- Deutsche Stiftung für Herzforschung
Publikationen
- Stangl V, Lorenz M. Why you should pay more attention to your cells' sex. J. Physiol. 2023;601(24):5581-5584. https://doi.org/10.1113/JP284819
- Lorenz M, Witt E, Völker U, Stangl K, Stangl V, Hammer E. Serum starvation induces sexual dimorphisms in secreted proteins of human umbilical vein endothelial cells (HUVECs) from twin pairs. Proteomics. 2022 Mar 31:e2100168. https://doi.org/10.1002/pmic.202100168
- Lorenz M, Blaschke B, Benn A, Hammer E, Witt E, Kirwan J, Fritsche-Guenther R, Gloaguen Y, Bartsch C, Vietzke A, Kramer F, Kappert K, Brunner P, Nguyen HG, Dreger H, Stangl K, Knaus P, Stangl V. Sex-specific metabolic and functional differences in human umbilical vein endothelial cells from twin pairs. Atherosclerosis. 2019;291:99-106. https://doi.org/10.1016/j.atherosclerosis.2019.10.007
- Witt E, Lorenz M, Völker U, Stangl K, Hammer E, Stangl V. Sex-specific differences in the intracellular proteome of human endothelial cells from dizygotic twins. J. Proteomics. 2019;201:48-56. https://doi.org/10.1016/j.jprot.2019.03.016
- Oettel A, Lorenz M, Stangl V, Costa SD, Zenclussen AC, Schumacher A. Human umbilical vein endothelial cells foster conversion of CD4+CD25-Foxp3- T cells into CD4+Foxp3+ regulatory T cells via transforming growth factor-β. Sci. Rep. 2016;6:23278. https://doi.org/10.1038/srep23278
- Lorenz M, Koschate J, Kaufmann K, Kreye C, Mertens M, Kuebler WM, Baumann G, Gossing G, Marki A, Zakrzewicz A, Miéville C, Benn A, Horbelt D, Wratil PR, Stangl K, Stangl V. Does cellular sex matter? Dimorphic transcriptional differences between female and male endothelial cells. Atherosclerosis. 2015;240:61-72. https://doi.org/10.1016/j.atherosclerosis.2015.02.018
